| Језик : |
|
| Енциклопедија заједница |Енциклопедија Одговори |Пошаљи питање |Речник Знање |Додај знања |
Хунд владавина |
 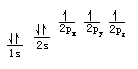 |
|
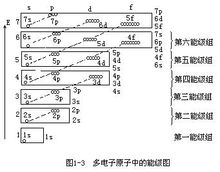
На стази енергије еквивалентне, број електрона са паралелним окреће, најнижа енергија атома. Дакле, енергија еквивалентна стаза, паралелно спин колико различитих нумера. Такав као атом угљеника има шест електрона, по принципу минималне енергије и Паули принцип искључења, пре свега постоје два електронски аранжман на првом слоју 1с Орбитал, друга два попуните други слој 2с електрона орбиту преостала два електрона стр распоређени у два колосека, са истом смеру окретања, а не концентрисана у два електрона п Орбитал, ротације у супротном смеру.Обим Ово подешавање важи само за случај ЛС спојнице. Постоји неколико изузетака због конфигурације ЛС спојница интеракцију или одступање изазива. Ова поставка је доступна теорија и квантна механика да објасни принцип искључења Паули. Ова поставка је за одређивање слободног државне атома или јона корисне. Хунд владавина премиса Хунд је правило премиса: За атома основном стању је На стази енергије еквивалентне, број електрона са паралелним окреће, најнижа енергија атома. Дакле, енергија еквивалентна стаза, паралелно спин колико различитих нумера. Такав као атом угљеника има шест електрона, по принципу минималне енергије и Паули принцип искључења, пре свега постоје два електронски аранжман на првом слоју 1с Орбитал, друга два попуните други слој 2с електрона орбиту преостала два електрона распоређени у два различита 2П орбитама са истом смеру окретања, а не концентрисана у два електрона п Орбитал, ротације у супротном смеру. Хунд је правило као допуна нумере пуне енергије једнак пуна, пола пуна или потпуно празна стање је релативно стабилно. У складу са наведеним принципима, електрони у атомских орбитала се попуњавају по редоследу аранжмана 1с 2с 2п 3с 3п 4с 4п 5с 3д 4д 5д 5п 6с 4ф 6п 7с 5ф 6Д .... Детаљније Детаљи: За посебно електронске аранжмана, различите конфигурације ЛС спојници, Хунд Правила за утврђивање редоследа енергије: () Већи укупан спин С, нижи енергетски (2) С једнаким условима, већа укупна орбитални угаони моменат Л, нижи енергетски (3) У случају С и Л једнаки, за нешто мање од пола-пола-схелл или граната, мањи укупан момент импулса Ј нижи енергетски супротном, Ј већа мања енергија. Овде користимо три принципа атомских електрона припремиле да разговарају неколико примера екстрануклеарних аранжмана. Азот (Н) атом има седам електроне, по принципу минималне енергије и Паули принцип искључења, постоје два прва електронска аранжман на првом слоју у 1с Орбитал, постоје два електронски аранжман на другом слоју У 2с пратите. Хунд је правило у складу са преостале три електрон спин на исти начин ће бити распоређени на три односно различитим правцима, али исто енергију у 2п орбити. Електронска распоред атома азота формуле 1С2 2С2 2П3. Квантна броја н и л електронски аранжман режим, под називом електронски облик или електронске конфигурације, горњи десни угао на слици је број електрона у орбити. Упоредите следеће формуле се такође може користити да се покаже да ова електронска слика магнетног квантног броја и квантни број спина: Неон (Не) атом има 10 електрона, на основу три принципа електронског аранжмана, први електронске љуске има два електронска аранжмане 1с Орбитал, а други слој има осам електрона, које су распоређене у две 2с стаза, 6 договорили да 2п орбиту. Дакле, атомска структура неон електронска конфигурација се може изразити као 1С2 2с22п6. Спољашњи омотач електронске структуре 8, обично релативно стабилна структура, познат као редак гаса структура. Натријум (На) има 11 електрона ван језгра, у складу са електронском аранжмана како, последњи треба да буде испуњен на трећа граната електрона, то је електронска конфигурација 1С2 2С2 2П6 3с1. Да би се избегло претешке писања електронске структуре, унутрашња облога може бити ретки гаса достигао део конструкције писане као "атомског језгра", у ретким симбол гаса елемента примењен рекао заграде, на пример, натријум атом електронска структура се може изразити као [Не] 3с1 Калијум (К) ван нуклеус укупно 19 електрона, због 3д и 4с орбитала затетурао, први 19-е испуњен 4с орбитални него испуњен 3д орбитална, а његова електронска конфигурација 1С2 2С2 2П6 3С2 3п6 4с1 или [Ар ] 4с1. Слично томе, на 20. елементарног калцијума (Ца) у одељцима 19, 20 су такође пуни 4с орбите електрона, атома калцијума електронска конфигурација [Ар] 4С2. Хром (Цр) атом има 24 електрона, највиши ниво група има шест електрона. Цхроме електронска конфигурација [Ар] 3Д5 4с1, уместо [АР] 3д4 4С2. То је због напола пуна 3Д5 ниже енергетске структуре је стабилна структура. Хунд је владавина Хунд правило је еквивалентна нумере (односе се на ту граната, електронски под-слој на сваком путу) о расподели електрона ће делити што је више могуће различите орбите, и СПИН у истом смеру. Је доказана квантне механике, електронике могу се организовати тако да најнижа енергија, тако да Хунд правила такође бити укључени у принципу у најнижем енергије. Хунд је правило два Хунд је правило, такође познат као орбиталне еквиваленције правила. У истом под-слоја распоредом електрона е, увек даје приоритет да заузимају различите нумере, а спина у истом смеру. Као што су атом азота 3 П 3 П дистрибуцији електрона у истом оријентације у орбити и спин оријентације. П има три електрона орбиту, Д орбиту електроне и 5, Ф орбита има седам електроне, стабилна структура је напола пуна. Друга студија квантне механике, еквивалентно нумера потпуно празан (п0, д0, ф 0) и пуно пуно (П6, Д10, Ф14) структуре, уз мању потрошњу и већу стабилност. Као и Фе3 јона гвожђа (3Д5) и обојених јона Фе2 (3Д6) Види, контраста од 3Д6 → 3Д5 је стабилан, што је нестабилна и подложна оксидацији обојених јона у складу са чињеницама. Према Хунд је правило стила хромираним електронском аранжмана треба да буде 1С2 2С2 2П6 3С2 3п6 4с1 3Д5. Хунд је правило изузетак Када истом нивоу на сваком путу електронском аранжмана је пуна, пола пуна или потпуно празан, систем омогућава најнижу енергију. [1] Као што су у 24. елемента хрома (Цр) електронски аранжман 1С2 2С2 2П6 3С2 3п6 4с1 3Д5 29. Елемент бакра (Цу) електронски аранжман 1С2 2С2 2П6 3С2 3п6 4с1 3Д10 Хунд пуно изузетака од правила, као што су "атомских орбитала, сваки један и по пуним или потпуно пун енергије минимума", односно С1, 2, П3, Д5, 6, 10, 14 Ф7, када најнижу енергију најстабилнији , ту је општи облик атома, али само погледајте периодног ћете наћи следећи редови дошли у неколико типова елемената, посебно лантанида и актиниде мало упознам Хунд владавину, која је сада теорија необјашњив. |
| Корисник Преглед |
|
Но цомментс иет |