| Језик : |
|
| Енциклопедија заједница |Енциклопедија Одговори |Пошаљи питање |Речник Знање |Додај знања |
Релативна нестабилност |
     |
|
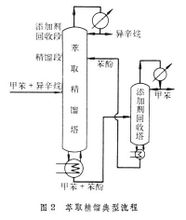
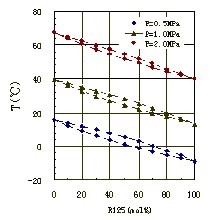
Кратак увод Релативна нестабилност: уобичајено да испарљивих компоненти у раствору степена претварање у пару од испарљивих компоненти хард волатилности, је познат као релативне нестабилности. Изражено од α. Дефиниција релативне променљивости α формулеα = (ВЈ / иБ) / (ка / кБ), формула, иа - паре фаза кртица делић испарљивих компоненти; иБ - мање испарљиве компоненте из гасовите фазе фракције кртица; КСА - течна фаза кртица делић испарљивих компоненти; КСБ - мање испарљиве компоненте у фази течне фракције кртица. Специфична извођење Представља два однос гаса фазе кртица фракције у течне фазе у равнотежи са два-пута моларном α фракција однос. Течна мешавина две компоненте у односу равнотеже односа. Компонента за компоненте Б, релативна нестабилност каб може се изразити као: КА = αАБ / МБ (1) КА и КБ, при чему су компоненте А и Б, односно, однос равнотежа (види процес масовног раздвајања). Иста мешавина, нестабилно компонента велике, опште равнотеже однос, испарљивих компоненти на релативну волатилност на мање испарљиве компоненте је већа од 1, у супротном мање од 1. Равнотежа је дефинисан однос према формули (1) може се преписивати као: једначина 2. Где кА иА и компонента били у гасовите фазе и течне фазе кртица фракција; иБ и кБ, односно, компоненте Б у гасовите фазе и течне фазе кртица фракције. За компоненте А и Б формирају две компоненте смеше, иа = 1-иБ, ка = 1-хв. Што може да доведе имати: 3 Једначина (3) показује да: ако αАБ већи од 1, иа од Кса, односно да се повећа гасовите фазе концентрације компоненти, је још нестабилна компонента. αАБ имају више од 1, онда кА иА је довољно велика него више, као αАБ мање од 1, мање од иа ка, компонента Б који је обогаћен у фази паре добијене, Б је више променљива компонента. αАБ више довољно мали, онда и Б концентрација у гасовите фазе раста више изузетан. Када αАБ једнак 1, онда иА једнак Кса, сугеришући да то не може бити одвојена дестилацијом мешавине. Дакле, степен одступања са 1 αАБ дестилацију операције је лакоћа одвајања течне смеше симбола. Када смеса у течној фази и гасовите фазе је идеално решење, идеално за гас, примена парцијалног притиска закона Раоулт и Далтоновим законом, по формули (2) изведене: αАБ = п2/п1 Тамо где П1 и П2 односно, компоненте А и Б су засићене паре притиска. У овом тренутку релативна нестабилност засићене паре притиска двије компоненте (мера променљивости чисте компоненте) однос. За идеалан систем, релативна нестабилност мешавине и температуре зависност је веома мали, може се сматрати константа инжењеринг. Али снажна концентрација на не-идеалним системима релативна волатилност има већи утицај. Поред тога, понекад у индустрији додавањем смесу да буде одвојен одређене адитиве за повећање релативне нестабилности између компоненти, тешко је користити мешавину нормалног дестилације постаје лако да буду одвојени. Ово је екстрактивне дестилација, азеотропиц дестилацију и исправљање, и других специјалних исправљање соли темељ. |
| Корисник Преглед |
|
Но цомментс иет |